- Главная
- Для учителя
- Архив заданий олимпиад по физике за 2009-2015 годы
- Владимир Анатольевич Зверев предлагает
- Несколько ссылок на работы Анатолия Шперха
- Общие вопросы методики обучения физике
- Статьи Александра Борисовича Рыбакова
- Важнейший общефизический принцип остается непонятым
- Рыбаков А. Б. Почитаем «Физику» вместе
- Рыбаков А.Б. Несколько замечаний о «Физике (ПС)», №10, 2015
- Рыбаков А.Б. О №12 «Физики (ПС)» и динамике автомобиля, или Спасут ли школу вузовские преподаватели?
- А.Б.Рыбаков Банджи-джампинг, сохранение импульса и уравнение Мещерского
- Рыбаков А.Б. О вращении Земли и всяком таком, или Удивительная физика в журнале «Физика (ПС)», №2/2015
- Экзамены
- Конспекты
- История физики
- Хронология физики
- Физики. Краткие биографии
- Дополнения к биографиям
- Нобелевские премии по физике
- История методики обучения физике
- Календарь на текущий год
- Физический календарь на 2026 год
- Физический календарь на 2025 год
- Календарь памятных дат в физике на 2023 год
- Юбилейные и памятные даты из истории физики в 2022 году
- Физический календарь на 2015 год
- Физический календарь на 2016 год. ч. 1
- Физический календарь на 2016 год. ч. 2
- Календарь памятных дат в физике на 2019 год
- Физики в Петербурге-Петрограде-Ленинграде
- Библиотека
- Медиатека
- О нас
Определения по МКТ и термодинамике
АБСОЛЮТНАЯ ВЛАЖНОСТЬ – физическая величина, равная отношению массы водяного пара в воздухе к его объему.  Практической единицей А.в. является
Практической единицей А.в. является ![]() .Иногда под А.в. понимают парциальное давление водяного пара. В этом случае ее измеряют в паскалях (Па).
.Иногда под А.в. понимают парциальное давление водяного пара. В этом случае ее измеряют в паскалях (Па).
АБСОЛЮТНАЯ ТЕМПЕРАТУРА - температура, измеряемая по абсолютной термодинамической шкале, не зависящей от свойств термометрического вещества. Отсчитывается от абсолютного нуля. Единица А.т. в СИ Кельвин (К).
АБСОЛЮТНЫЙ НУЛЬ - начало отсчета абсолютной температуры; находится на 273.16 К ниже температуры тройной точки воды, для которой принято значение 0.01оС. При А.н. прекращается поступательное и вращательное движение атомов и молекул, но они находятся не в покое, а в состоянии "нулевых" колебаний. Из законов термодинамики следует, что А.н. практически недостижим.
АВОГАДРО ЗАКОН - один из основных законов идеальных газов: в равных объемах различных газов при одинаковой температуре и давлении содержится одинаковое число молекул. Открыт в 1811 году итал. физиком А.Авогадро(1776-1856).
АВОГАДРО ПОСТОЯННАЯ (число) - число частиц в единице количества вещества (в 1 моль): NA=6,022. 1023 моль-1.
АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА - состояния одного и того же вещества, отличающиеся характером теплового движения частиц. Обычно различают 3 А.с.в.: газ, жидкость и твердое тело; иногда сюда относят и плазменное состояние. Вещество в любом А.с. существует при определенных внешних условиях (температура, давление), изменение которых приводит к переходу из одного А.с. в другое.
АДИАБАТИЧЕСКИЙ (АДИАБАТНЫЙ) ПРОЦЕСС – модель термодинамического процесса, при котором отсутствует теплообмен между рассматриваемой системой и окружающей средой. Реальный термодинамический процесс может рассматриваться как А., если он происходит либо в теплоизолирующей оболочке, либо настолько быстро, чтобы теплообмен не успел произойти.
АДИАБАТА - линия, изображающая на любой термодинамической диаграмме равновесный адиабатический процесс. Уравнение а. для идеального газа имеет вид 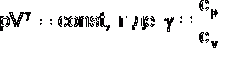 - показатель адиабаты, а сp и сv теплоемкости при постоянном давлении и объеме соответственно.
- показатель адиабаты, а сp и сv теплоемкости при постоянном давлении и объеме соответственно.
АМОРФНОЕ СОСТОЯНИЕ - состояние твердого вещества, при котором отсутствует дальний порядок расположения молекул. Поэтому а. вещество обладает изотропией, т.е. имеет одинаковые физические свойства по всем направлениям, и не имеет определенной точки плавления.
АНЕРОИД - барометр-анероид, прибор для измерения атмосферного давления, приемной частью которого служит металлическая коробка, внутри которой создано сильное разряжение. При изменении атм. давления изменяется деформация коробки, которая с помощью связанной с ней пружины и системы рычагов, вызывает поворот стрелки-указателя.
АНИЗОТРОПИЯ - зависимость физических свойств вещества от направления (в противоположность изотропии). Связана с внутренним упорядоченным строением сред и обнаруживается в явлениях упругости, тепло- и электропроводности, распространения звука и света в твердых телах. Может быть присуща и физическому пространству при наличии электромагнитного, гравитационного и других полей.
АТМОСФЕРНОЕ ДАВЛЕНИЕ - давление, которое оказывает атмосфера Земли на все находящиеся в ней предметы. Определяется весом вышележащего столба воздуха и является наиболее важной величиной, описывающей состояние земной атмосферы. Единицы А.д. в СИ - Па, мм рт.ст. Нормальное А.д. равно 760 мм рт.ст. или 1013 гПа.
БАРОМЕТР - прибор для измерения атмосферного давления. Наиболее часто встречаются деформационные Б., к которым, например, относится Б.-анероид (1844 г., Л.Види). В таком Б. при изменении атмосферного давления прогибается мембрана, закрывающая коробку, из которой откачан воздух, при этом происходит отклонение стрелки, связанной с мембраной через систему рычагов. Действие жидкостного Б. (например, ртутный Б. Э.Торричелли, 1644 г.) основано на уроавновешивании сиалы атмосферного давления весом столба жидкости.
БЛИЖНИЙ ПОРЯДОК - упорядоченное расположение атомов или молекул в пределах расстояний, близких к межатомным; характерен для аморфных веществ и некоторых жидкостей. (Ср.дальний порядок).
БОЙЛЯ-МАРИОТТА ЗАКОН - один из законов идеального газа: для данной массы данного газа при постоянной температуре произведение давления на объем есть величина постоянная. Формула: pV=const. Описывает изотермический процесс.
БОЛЬЦМАНА ПОСТОЯННАЯ - одна из основных физических постоянных, равная отношению универсальной газовой постоянной R к Авогадро постоянной NA .Б.п. 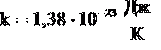 .Входит в ряд важнейших соотношений статистической физики: связывает ср. кинетическую энергию частиц и температуру, энтропию физической системы и ее термодинамическую вероятность.
.Входит в ряд важнейших соотношений статистической физики: связывает ср. кинетическую энергию частиц и температуру, энтропию физической системы и ее термодинамическую вероятность.
БРОУНОВСКОЕ ДВИЖЕНИЕ - беспорядочное движение мелких макроскопических частиц, взвешенных в жидкости или газе, происходящее под влиянием теплового движения молекул. Наглядное подтверждение молекулярно-кинетической теории. Открыто Р.Броуном в 1827 г. Объяснено А. Эйнштейном и М. Смолуховским в 1905 г. Теория проверена в опытах Ж. Перрена в 1906-11 г.
ВАКУУМ - состояние заключенного в сосуд газа, имеющего давление значительно ниже атмосферного. В зависимости от соотношения между длиной свободного пробега атомов или молекул и линейным размером сосуда различают сверхвысокий, высокий, средний и низкий вакуум.
ВЛАЖНОСТЬ ВОЗДУХА – явление наличия в воздухе водяного пара. Описывается физическими величинами абсолютной иотносительной В., которые измеряются гигрометрами.
ВНУТРЕННЯЯ ЭНЕРГИЯ - энергия тела, зависящая только от его внутреннего состояния; складывается из энергии беспорядочного (теплового) движения атомов, молекул или других частиц и энергии внутриатомных и межмолекулярных движений и взаимодействий. (См.первый закон термодинамики). В МКТ энергия внутриатомных частиц и их взаимодействий не учитывается.
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ - один из основных законов термодинамики, согласно которому невозможен периодический процесс единственным результатом которого является совершение работы, эквивалентной количеству теплоты, полученному от нагревателя. Другая формулировка: невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от менее нагретого тела к более нагретому. В.з.т. выражает стремление системы, состоящей из большого количества хаотически движущихся частиц, к самопроизвольному переходу из состояний менее вероятных в состояния более вероятные. Еще один способ формулировки в.з.т: невозможно создание вечного двигателя второго рода.
ГАЗ - одно изагрегатных состояний вещества, в котором его частицы слабо связаны между собой силами молекулярного притяжения и движутся хаотически, заполняя весь возможный объем, поэтому газы легко сжимаемы, летучи. Для описания свойств газа используются модели с различной степенью приближения к реальности. Так при малых плотностях Г. практически можно считать идеальным газом. Ср.жидкость, твердое тело. См. также Клапейрона-Менделеева уравнение.
ГАЗОВАЯ ПОСТОЯННАЯ УНИВЕРСАЛЬНАЯ (R) - одна из основных физических постоянных, входящая в уравнение состояния (См. Клапейрона-Менделеева уравнение). R=(8,31441±0,00026) Дж/(моль·К). Физический смысл: работа расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К.
ГАЗОВЫЙ ТЕРМОМЕТР - прибор для измерения температуры, действие которого основано на зависимости давления или объема газа от температуры.
ГЕЙ-ЛЮССАКА ЗАКОН – один из законов идеального газа: для данной массы данного газа при постоянном давлении отношение объема к абсолютной температуре есть величина постоянная:  (или: объем прямо пропорционален абсолютной температуре:
(или: объем прямо пропорционален абсолютной температуре: ![]() , где α – температурный коэффициент давления). Описывает изобарный процесс.
, где α – температурный коэффициент давления). Описывает изобарный процесс.
ГИГРОМЕТР – прибор для измеренияабсолютной или относительной влажности воздуха. Г. подразделяют на весовые (для определения абсолютной влажности), конденсационные (для определения точки росы), волосовые (относительная влажность), а также Г. психрометрические или психрометры (относительная влажность).
ГРАДУС ЦЕЛЬСИЯ – внесистемная единица температуры по Международной практической температурной шкале, где температура тройной точки воды равна 0,01 градуса Цельсия, а температура кипения при нормальном атмосферном давлении 100 градусов Цельсия.
ДАЛЬНИЙ ПОРЯДОК – упорядоченное расположение частиц (атомов или молекул) во всем объеме тела; характерен для кристаллических веществ. Ср.ближний порядок.
ДАЛЬТОНА ЗАКОН – один из основных законов идеального газа: давление смеси химически не взаимодействующих газов равно сумме парциальных давлений этих газов.
ДЕФЕКТЫ В КРИСТАЛЛАХ – несовершенства кристаллического строения, нарушения строгого периодического расположения частиц ( атомов, молекул, ионов) в узлах кристаллической решетки. К ним относятся вакансии (точечные дефекты), дислокации (линейные дефекты), объемные дефекты: трещины, поры, раковины и т.д. Оказывают существенное влияние на физические свойства кристаллов.
ДИСЛОКАЦИИ – линейные дефекты кристаллической решетки, нарушающие правильное чередование атомных плоскостей. В двух измерениях имеют размеры порядка размеров атома, а в третьем - могут проходить через весь кристалл.
ДИССОЦИАЦИЯ – процесс распада молекул на более простые части - атомы, группы атомов или ионы. Может происходить при повышении температуры (термическая Д.), в растворе электролитов (электролитическая Д.) и под действием света (фотохимическая Д.).
ДИФФУЗИЯ – процесс распространения вещества в какой-либо среде в направлении убывания его концентрации, обусловленное тепловым движением атомов, молекул, ионов и др. более крупных частиц. (Посмотреть фильм "Диффузия")
ЖИДКИЕ КРИСТАЛЛЫ – состояние вещества, в котором обнаруживаются структурные свойства, промежуточные между твердым кристаллом ижидкостью. Образуются в веществах с молекулами продолговатой формы, взаимная ориентация которых обусловливает анизотропию их физических свойств. Применяются в технике, биологии и медицине.
ЖИДКОСТНЫЙ ТЕРМОМЕТР – прибор для измерения температуры, действие которого основано на тепловом расширении жидкости. Ж.т. в зависимости от температурной области заполняют ртутью, этиловым спиртом и др. жидкостями.
ЖИДКОСТЬ – одно из агрегатных состояний вещества, промежуточное между твердым и газообразным. Ж., как и твердое тело, обладает малой сжимаемостью, большой плотностью и в то же время. подобно газу, характеризуется изменчивостью формы (легко течет). Молекулы ж., как и частицы твердого тела, совершают тепловые колебания, однако их положение равновесия время от времени меняется, что и обеспечивает текучесть жидкости.
ИДЕАЛЬНЫЙ ГАЗ – мысленная модель газа, в которой силами взаимодействия между частицами и размерами этих частиц можно пренебречь. Т.е. частицы принимаются за материальные точки, а все взаимодействие сводится к их абсолютно упругим ударам. Разреженные газы при температурах, далеких от температуры конденсации, близки по своим свойствам к И.г. Уравнением состояния служит Клапейрона - Менделеева уравнение.
ИЗОБАРА – линия постоянного давления, изображающая на диаграмме состояния равновесный изобарный процесс.
ИЗОБАРНЫЙ ПРОЦЕСС (изобарический) – мысленная модель термодинамического процесса, протекающего при постоянном давлении. Для идеальных газов описывается законом Гей-Люссака.
ИЗОПРОЦЕССЫ – физические процессы, протекающие при постоянстве какого-либо из описывающих состояние системы параметоров (см. изобарный, изотермический, изохорный процесс).
ИЗОТЕРМА – линия постоянной температуры, изображающая на диаграмме состояния равновесный изотермический процесс.
ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС – модель термодинамического процесса, протекающего при постоянной температуре. Напр., кипение химически однородной жидкости, плавление химически однородного кристалла при постоянном внешнем давлении. Для идеальных газов описывается Бойля-Мариотта законом. Ср.изобарный, изохорный, адиабатный процесс.
ИЗОТРОПИЯ, изотропность – одинаковость физических свойств во всех направлениях. Связано с отсутствием упорядоченного внутреннего строения сред и присуща газам, жидкостям (кроме жидких кристаллов) и аморфным телам. Ср. анизотропия.
ИЗОХОРА - линия постоянного объема, изображающая на диаграмме состояния равновесный изохорный процесс.
ИЗОХОРНЫЙ ПРОЦЕСС, изохорический процесс - термодинамический процесс, происходящий при постоянном объеме системы. Для идеальных газов описывается Шарля законом.
ИСПАРЕНИЕ – процесс парообразования со свободной поверхности жидкости при температуре ниже температуры кипения. И. с поверхности твердых тел называют возгонкой. (Ср. кипение, парообразование).
КАЛОРИМЕТР - прибор для определения различных калориметрических величин: теплоемкости, теплоты сгорания, теплоты парообразования и т.д.
КАПИЛЛЯР – узкий сосуд с характерным размером поперечного сечения менее 1 мм.
КАПИЛЛЯРНЫЕ ЯВЛЕНИЯ - явления, вызываемые влиянием сил межмолекулярного взаимодействия на равновесие и движение свободной поверхности жидкости, поверхности раздела несмешивающихся жидкостей и границ жидкостей с твердыми телами. Например, поднятие или опускание жидкости в очень тонких трубках (капиллярах) и в пористых средах.
КАРНО ЦИКЛ – мысленная модель обратимого кругового процесса, состоящего из двух изотермических и двух адиабатных процессов. При изотермическом расширении (температура нагревателя Tн) рабочему телу (идеальному газу) сообщается количество теплоты Qн, а при изотермическом сжатии (температура холодильника Тх) - отводится количество теплоты Qx. Кпд К.ц. не зависит от природы рабочего тела и равен  .
.
КИПЕНИЕ - процесс интенсивного парообразования не только со свободной поверхности жидкости, но и по всему ее объему внутрь образующихся при этом пузырьков пара. Температура К. зависит от природы жидкости и внешнего давления и находится между тройной точкой и критической температурой (см. критическое состояние).
КЛАПЕЙРОНА-МЕНДЕЛЕЕВА УРАВНЕНИЕ - уравнение состояния идеального газа:  ,где p- давление, V- объем, T - абсолютная температура, m - масса, M - молярная масса газа, R - универсальная газовая постоянная. Из К.-М.у. вытекают законы Авогадро, Бойля-Мариотта, Шарля и Гей-Люссака.
,где p- давление, V- объем, T - абсолютная температура, m - масса, M - молярная масса газа, R - универсальная газовая постоянная. Из К.-М.у. вытекают законы Авогадро, Бойля-Мариотта, Шарля и Гей-Люссака.
КОЛИЧЕСТВО ВЕЩЕСТВА – количество молей, физическая величина, равная отношению числа структурных элементов (напр., атомов, молекул и т.д.) к Авогадро числу. Единица в СИ - моль.
КОЛИЧЕСТВО ТЕПЛОТЫ –физическая величина, равная части внутренней энергии, переданной в процессетеплообмена от одного макроскопического тела к другому без совершения работы. Единица в СИ - джоуль.
КОНДЕНСАЦИЯ – процесс перехода вещества из газообразного состояния в жидкое или кристаллическое. Сопровождается выделением теплоты. Процесс обратный парообразованию (испарению, кипению и возгонке). Играет важную роль в природе (образование облаков, тумана, росы, инея).
КРИСТАЛЛИЗАЦИЯ – процесс образования кристаллов из паров, растворов, расплавов в специальных установках или при химических реакциях. Играет важную роль в природе ( напр., образование минералов) и технике (выплавка металлов, получение полупроводниковых, оптических и др. материалов, нанесение тонкопленочных покрытий и т.д. В школьном курсе часто используется как синоним отвердевания, т.е. процесс, обратный плавлению.
КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА – мысленная модель, дающая возможность представить расположение атомов, ионов и молекул, характеризующееся периодической повторяемостью в пространстве и присущее твердым телам (кристаллам). Период К.р. составляет 0,1-0,5 нм для простых соединений, 1 - 2 нм для сложных неорганических и органических соединений, 10 нм для белков и вирусов.
КРИСТАЛЛЫ - твердые тела с упорядоченным взаимным расположением образующих их частиц - атомов, ионов, молекул. См. монокристаллы, поликристаллы.
КРИТИЧЕСКОЕ СОСТОЯНИЕ - состояние вещества, при котором две различные фазы (жидкая и газообразная), находящиеся между собой в равновесии, становятся тождественными по всем своим свойствам. Характеризуется критическим Давление, температуру и объемом, соответствующие К.с. называют критическими..
КРУГОВОЙ ПРОЦЕСС - цикл, модель термодинамического процесса, в результате которого рабочее тело возвращается в первоначальное состояние. Пример - Карно цикл.
МАЙЕРА УРАВНЕНИЕ - соотношение, устанавливающее связь между молярными теплоемкостями идеального газа при постоянном давлении сp и при постоянном объеме сV: сP =сV + R. где R - газовая постоянная.
МАКСВЕЛЛА РАСПРЕДЕЛЕНИЕ - закон распределения по скоростям молекул идеального газа, находящегося в состоянии термодинамического равновесия.
МАНОМЕТР - прибор для измерения давления жидкостей и газов. Различают М. для измерения абслютного давления, отсчитываемого от нуля, и М. для измерения избыточного давления (разности между абсолютным и атмосферным давлением). Различают жидкостные, поршневые, деформационные и пружинные М. в зависимости от принципа действия.
МЕНИСК - искривленная поверхность жидкости в узкой трубке (капилляре) или между близко расположенными твердыми стенками (см.капиллярные явления).
МОДУЛЬ ЮНГА – постоянная для данного материала физическая величина, являющаяся коэффициентом пропорциональности между механическим напряжением и относительным удлинением в Гука законе: ![]() . М.Ю. Е равен механическому напряжению, возникающему в деформированном теле при увеличении его длины в 2 раза. Единица измерения в СИ – паскаль.
. М.Ю. Е равен механическому напряжению, возникающему в деформированном теле при увеличении его длины в 2 раза. Единица измерения в СИ – паскаль.
МОЛЕКУЛА - наименьшая устойчивая частица вещества, обладающая всеми химическими свойствами и состоящая из одинаковых (простое вещество) или разных (сложное вещество) атомов, объединенных химическими связями. Ср. атом.
МОЛЕКУЛЯРНАЯ МАССА - масса молекулы, выраженная в атомных единицах массы. Ср. молярная масса.
МОЛЕКУЛЯРНАЯ ФИЗИКА - раздел физики, изучающий физические свойства тел, особенности агрегатных состояний вещества и процессы фазовых переходов в зависимости от молекулярного строения тел, сил межмолекулярного взаимодействия и характера теплового движения частиц (атомов, ионов, молекул). См. статистическая физика, термодинамика.
МОЛЯРНАЯ МАССА - масса одного моля вещества; скалярная величина, равная отношению массы тела к количеству вещества (числу молей), которое в нем содержится. В СИ м.м. равна молекулярной массе вещества, умноженной на 10-3 и измеряется в килограммах на моль (кг/моль).
МОНОКРИСТАЛЛЫ - одиночные кристаллы с единой кристаллической решеткой. Образуются в природных условиях или искусственно выращиваются из расплавов, растворов, парообразной или твердой фазы. Ср. поликристаллы.
НАСЫЩЕННЫЙ ПАР - пар, находящийся в динамическом равновесии с жидкой или твердой фазой. Под динамическим равновесием понимают такое состояние, при котором среднее число молекул, покидающих жидкость (твердое тело), равно среднему числу молекул пара, возвращающихся в жидкость (твердое тело) за то же время.
НЕОБРАТИМЫЙ ПРОЦЕСС - процесс, который может самопроизвольно протекать только в одном направлении. Все реальные процессы являются н.п. и в замкнутых системах сопровождаются возрастанием энтропии. См. обратимый процесс, второй закон термодинамики.
НОРМАЛЬНЫЕ УСЛОВИЯ - стандартные физические условия, определяемые давлением P=101325 Па (760 мм рт.ст.) и абсолютной температурой T=273,15 К.
ОБРАТИМЫЙ ПРОЦЕСС – модель процесса, для которого возможен обратный процесс, последовательно повторяющий все промежуточные состояния рассматриваемого процесса. Обратимым является лишь равновесный процесс. Пример - Карно цикл. Ср. необратимый процесс.
ОТНОСИТЕЛЬНАЯ ВЛАЖНОСТЬ – физическая величина, равная отношению плотности (упругости) водяного пара, содержащегося в воздухе, к плотности (упругости) насыщенного пара при той же температуре. Выражается в процентах. Ср. абсолютная влажность.
ПАР - вещество в газообразном состоянии в условиях, когда путем сжатия можно добиться равновесия с тем же веществом в жидком или твердом состоянии, т.е. при температурах и давлениях ниже критических (см. критическое состояние). При низких давлениях и высоких температурах свойства пара приближаются к свойствам идеального газа.
ПАРАМЕТР СОСТОЯНИЯ, термодинамический параметр – физическая величина, которая служит в термодинамике для описания состояния системы. Напр., давление, температура, внутренняя энергия, энтропия и т.д. П.с. взаимосвязаны, поэтому равновесное состояние системы можно однозначно определить ограниченным числом параметров (см. уравнение состояния).
ПАРООБРАЗОВАНИЕ – процесс перехода вещества из жидкого или твердого состояния в газообразное. В замкнутом объеме идет до тех пор, пока не образуется насыщенный пар. Различают два вида П.: испарение и кипение.
ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ - давление газа, входящего в состав газовой смеси, которое он оказывал бы, занимая один весь объем смеси и находясь при температуре смеси. См. Дальтона закон.
ПАСКАЛЯ ЗАКОН - основной закон гидростатики:давление, производимое внешними силами на поверхность жидкости или газа, передается одинаково по всем направлениям.
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ - один из основных законов термодинамики, являющийся законом сохранения энергии для термодинамической системы: количество теплоты Q, сообщенное системе, расходуется на изменение внутренней энергии системы ΔU и совершение системой работы Aсист против внешних сил. Формула: Q=ΔU+Aсист. На использовании П.з.т. основана работа тепловых машин. Можно сформулировать по-другому: изменение внутренней энергии системы ΔU равно сумме переданного системе количества теплоты Q и работы внешних сил над системой Aвнеш. Формула: ΔU=Q+Aвнеш. В указанных формулах Aвнеш.= - Aсист.
ПЛАВЛЕНИЕ – процесс перехода вещества из кристаллического состояния в жидкое. Происходит с поглощением некоторого количества теплоты при температуре плавления, зависящей от природы вещества и давления. См. теплота плавления.
ПЛАЗМА - ионизированный газ, в котором концентрации положительных и отрицательных зарядов практически одинаковы. Образуется при электрическом разряде в газах, при нагревании газа до температуры, достаточной для термической ионизации. В состоянии плазмы находится подавляющая часть вещества Вселенной: звезды, галактические туманности и межзвездная среда.
ПЛАСТИЧНОСТЬ - свойство твердых тел под действием внешних сил изменять, не разрушаясь, свою форму и размеры и сохранять остаточные (пластические) деформации после того, как действие внешних сил прекратится. Ср. хрупкость.
ПЛОТНОСТЬ - скалярная величина, равная отношению массы тела к его объему: . Одна из основных величин, применяемых для описания и сравнения веществ. В СИ измеряется в
. Одна из основных величин, применяемых для описания и сравнения веществ. В СИ измеряется в ![]() .
.
ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ КОЭФФИЦИЕНТ – физическая величина равная отношению работы внешних сил по изменению площади поверхности жидкости к величине этого изменения площади при постоянной температуре:  . Зависит от рода жидкости и температуры. Может изменяться под действием поверхностноактивных веществ (напр., мыло).
. Зависит от рода жидкости и температуры. Может изменяться под действием поверхностноактивных веществ (напр., мыло).
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ – явление, выражающееся в стремлении жидкости к уменьшению площади своей поверхности. Обусловлено межмолекулярным взаимодействием и вызвано образованием поверхностного слоя молекул, энергия которых больше, чем энергия молекул внутри данной жидкости при той же температуре.
