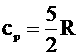- Главная
- Для учителя
- Архив заданий олимпиад по физике за 2009-2015 годы
- Владимир Анатольевич Зверев предлагает
- Несколько ссылок на работы Анатолия Шперха
- Общие вопросы методики обучения физике
- Статьи Александра Борисовича Рыбакова
- Важнейший общефизический принцип остается непонятым
- Рыбаков А. Б. Почитаем «Физику» вместе
- Рыбаков А.Б. Несколько замечаний о «Физике (ПС)», №10, 2015
- Рыбаков А.Б. О №12 «Физики (ПС)» и динамике автомобиля, или Спасут ли школу вузовские преподаватели?
- А.Б.Рыбаков Банджи-джампинг, сохранение импульса и уравнение Мещерского
- Рыбаков А.Б. О вращении Земли и всяком таком, или Удивительная физика в журнале «Физика (ПС)», №2/2015
- Экзамены
- Конспекты
- История физики
- Хронология физики
- Физики. Краткие биографии
- Дополнения к биографиям
- Нобелевские премии по физике
- История методики обучения физике
- Календарь на текущий год
- Физический календарь на 2026 год
- Физический календарь на 2025 год
- Календарь памятных дат в физике на 2023 год
- Юбилейные и памятные даты из истории физики в 2022 году
- Физический календарь на 2015 год
- Физический календарь на 2016 год. ч. 1
- Физический календарь на 2016 год. ч. 2
- Календарь памятных дат в физике на 2019 год
- Физики в Петербурге-Петрограде-Ленинграде
- Библиотека
- Медиатека
- О нас
Теплопередача
|
ТЕПЛОПЕРЕДАЧА |
|||||
|
Теплопередача (теплообмен) - процесс изменения внутренней энергии без совершения работы. |
|
||||
|
Количественная характеристика - количество теплоты - часть изменения внутренней энергии, происходящего в процессе теплопередачи. Обозначается Q. Единицы измерения: Дж, кал (калория). 1 кал = 4,19 Дж. |
1 кал = 4,19 Дж |
||||
|
Виды теплопередачи: |
|||||
|
|
||||
|
Расчет количества теплоты. |
|||||
|
1. Изменение температуры. Q = cm(Т2-Т1) = cmΔТ. Величина с наз. удельной теплоемкостью. Она характеризует тепловые свойства вещества по его способности к изменению температуры. Удельная теплоемкость показывает на сколько изменяется внутренняя энергия 1 кг данного вещества при изменении его температуры на 1 К. Единица измерения Дж/кг.К. Q=CΔT. Величина С называется теплоемкостью тела. С=сm. Q = cνmΔT. Величина cν называется молярной теплоемкостью (теплоемкость 1 моля вещества). |
Изменение температуры: Q = cm(t°2-t°1)=cm(Т2-Т1) = cmΔТ Q = cmΔt°. |
||||
|
2. Плавление и отвердевание вещества. |
Плавление и отвердевание вещества Q=± λm
|
||||
|
3. Парообразование и конденсация вещества. Q = Lm = rm. |
Q = ±Lm = ±rm
|
||||
|
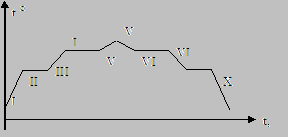
I – нагревание твердого тела; II – плавление твердого тела; III – нагревание жидкости; IV – кипение; V – нагревание газа; VI – охлаждение газа; VII – конденсация; VIII – охлаждение жидкости; IX – кристаллизация (отвердевание); X – охлаждение твердого тела. |
|
||||
|
4. Сгорание топлива. Q = qm. q - удельная теплота сгорания топлива. Дельная теплота сгорания топлива показывает сколько энергии выделяется при полном сгорании 1 кг данного вещества. Единица q Дж/кг. Сгорание - соединение с кислородом. При горении изменяется взаимное расположение частиц вещества, следовательно, меняется их потенциальная энергия, а значит, внутренняя энергия вещества. Вещества, при горении которых выделяется энергия, являются топливом. Qполученное>0, Qвыделенное<0 Согласно закону сохранения энергии алгебраическая сумма всех количеств теплоты равна нулю (все переданное количество теплоты равно по модулю всему полученному): Q1 + Q2 + Q3 +...= 0 - уравнение теплового баланса. С учетом потерь на нагревание окружающей среды: ηQпереданное = Qполученное, где η - кпд нагревательного прибора. |
Q = qm
|
||||
|
Q1 + Q2 + Q3 +...= 0 - уравнение теплового баланса. |
|||||
|
ηQпереданное = Qполученное |
|||||
|
Теплоемкости газа при постоянном объеме и постоянном давлении. |
|||||
|
1.Молярная теплоемкость при постоянном объеме:
Но при изохорном процессе работа не совершается, следовательно: |
|
||||
|
2. Молярная теплоемкость при постоянном давлении: |
|
||||
|
3. Связь между теплоемкостями при постоянном давлении и постоянном объеме:
|
уравнекние Майера |
||||
|
4. Теплоемкость при изотермическом процессе: т.к. температура не меняется, то теплоемкость бесконечна. |
|

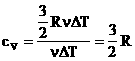 .
.
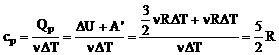 .
.