- Главная
- Для учителя
- Архив заданий олимпиад по физике за 2009-2015 годы
- Владимир Анатольевич Зверев предлагает
- Несколько ссылок на работы Анатолия Шперха
- Общие вопросы методики обучения физике
- Статьи Александра Борисовича Рыбакова
- Важнейший общефизический принцип остается непонятым
- Рыбаков А. Б. Почитаем «Физику» вместе
- Рыбаков А.Б. Несколько замечаний о «Физике (ПС)», №10, 2015
- Рыбаков А.Б. О №12 «Физики (ПС)» и динамике автомобиля, или Спасут ли школу вузовские преподаватели?
- А.Б.Рыбаков Банджи-джампинг, сохранение импульса и уравнение Мещерского
- Рыбаков А.Б. О вращении Земли и всяком таком, или Удивительная физика в журнале «Физика (ПС)», №2/2015
- Экзамены
- Конспекты
- История физики
- Хронология физики
- Физики. Краткие биографии
- Дополнения к биографиям
- Нобелевские премии по физике
- История методики обучения физике
- Календарь на текущий год
- Физический календарь на 2026 год
- Физический календарь на 2025 год
- Календарь памятных дат в физике на 2023 год
- Юбилейные и памятные даты из истории физики в 2022 году
- Физический календарь на 2015 год
- Физический календарь на 2016 год. ч. 1
- Физический календарь на 2016 год. ч. 2
- Календарь памятных дат в физике на 2019 год
- Физики в Петербурге-Петрограде-Ленинграде
- Библиотека
- Медиатека
- О нас
Природа электрического тока в растворах и расплавах электролитов. Явление электролиза. Закон электролиза Фарадея. Применение электролиза.
|
Природа электрического тока в растворах и расплавах электролитов |
||
|
Электролиты — жидкие проводники, в которых подвижными носителями зарядов являются ионы (проводники 2-го рода). |
|
|
|
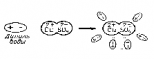
Электролитическая диссоциация. С. Аррениус (1877 г.): под действием полярных молекул растворителя (воды, ε=81) или при нагревании молекулы щелочей, кислот, солей разделяются на ионы. (При растворении Еп уменьшается и становится меньше Ек хаотического движения ионов. При нагревании - Ек увеличивается и становится больше Еп электрического взаимодействия ионов). Одновременно с диссоциацией наблюдается рекомбинация. Интенсивность электролитической диссоциации зависит: 1. От температуры раствора. 2. От концентрации раствора. 3. От рода раствора (его диэлектрической проницаемости). |
||
|
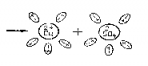
Электролизом называется процесс выделения на электродах вещества, связанный с окислительно-восстановительными реакциями при прохождении тока через электролит. |
||
|
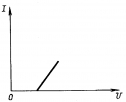
Вольтамперная характеристика для электролитов. За счет явления поляризации график смещен. ЭДС поляризации имеет знак, противоположный знаку напряжения на электродах. |
||
|
Ионная проводимость: прохождение тока связано с переносом вещества. |
|
|
|
Сопротивление растворов электролитов |
|
|
|
Уменьшается R с повышением температуры. Справедлив закон Ома при неизменной концентрации раствора и постоянной температуре. |
|
|
|
При электролизе на электродах происходит выделение вещества:
где m0i и q0i - соответственно масса и заряд иона; М — молярная масса; Ni — число ионов, достигших электрода, n — валентность;
Таким образом, |
|
|
|
В Международной системе единиц СИ: . Т.к. процесс электролиза медленный, то на практике применяют единицу |
|
|
|
Следовательно, |
|
|
|
Запишем: |
|
|
|
Обозначим
Физический смысл: Для выделения 1 моль одновалентного вещества необходимо пропустить через электролит заряд 96500 Кл. |
|
|
|
Закон электролиза: масса вещества, выделившегося на электродах прямо пропорциональна силе тока, идущего через электролит и времени прохождения тока (т.к. q=I.Δt, то: прямо пропорциональна заряду, прошедшему через электролит) |
|
|
|
Определение заряда электрона
Из закона электролиза: |
|
|
|
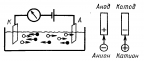
Катодные процессы :
|
Анодные процессы:
|
|