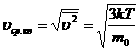- Главная
- Для учителя
- Архив заданий олимпиад по физике за 2009-2015 годы
- Владимир Анатольевич Зверев предлагает
- Несколько ссылок на работы Анатолия Шперха
- Общие вопросы методики обучения физике
- Статьи Александра Борисовича Рыбакова
- Важнейший общефизический принцип остается непонятым
- Рыбаков А. Б. Почитаем «Физику» вместе
- Рыбаков А.Б. Несколько замечаний о «Физике (ПС)», №10, 2015
- Рыбаков А.Б. О №12 «Физики (ПС)» и динамике автомобиля, или Спасут ли школу вузовские преподаватели?
- А.Б.Рыбаков Банджи-джампинг, сохранение импульса и уравнение Мещерского
- Рыбаков А.Б. О вращении Земли и всяком таком, или Удивительная физика в журнале «Физика (ПС)», №2/2015
- Экзамены
- Конспекты
- История физики
- Хронология физики
- Физики. Краткие биографии
- Дополнения к биографиям
- Нобелевские премии по физике
- История методики обучения физике
- Календарь на текущий год
- Физический календарь на 2026 год
- Физический календарь на 2025 год
- Календарь памятных дат в физике на 2023 год
- Юбилейные и памятные даты из истории физики в 2022 году
- Физический календарь на 2015 год
- Физический календарь на 2016 год. ч. 1
- Физический календарь на 2016 год. ч. 2
- Календарь памятных дат в физике на 2019 год
- Физики в Петербурге-Петрограде-Ленинграде
- Библиотека
- Медиатека
- О нас
Основные положения МКТ. Диффузия. Броуновское движение. Скорость теплового движения молекул.
| Основные положения МКТ | ||
|
Левкипп и Демокрит — 400 лет до н.э. М. В. Ломоносов — XVIII в. «0 причине теплоты и холода», «О коловратном движении корпускул». 1. Все вещества состоят из мельчайших частиц (молекул и атомов). Молекулы разделены промежутками. 2. Молекулы находятся в беспрерывном хаотическом движении. 3. Между молекулами существуют силы взаимодействия (притяжение и отталкивание). |
||
|
АТОМ - наименьшая частица химического элемента, которая является носителем его химических свойств. А. состоит из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в кулоновском поле ядра по законам квантовой механики. Размеры А. порядка 10-10 м. |
||
|
МОЛЕКУЛА - наименьшая устойчивая частица вещества, обладающая всеми химическими свойствами и состоящая из одинаковых (простое вещество) или разных (сложное вещество) атомов, объединенных химическими связями. |
||
|
Опытные обоснования МКТ |
||
|
Существование молекул |
|
|
|
Наличие промежутков |
|
|
|
Хаотическое движение молекул |
|
|
|
Силы взаимодействия |
|
|
|
Диффузия. Броуновское движение. |
||
|
Диффузия - явление проникновения частиц одного вещества в промежутки между частицами другого. Скорость диффузии зависит от температуры и состояния вещества (быстрее в газах). |
Фильм "Диффузия" | |
|
Броуновское движение - беспорядочное движение мелких частиц, взвешенных в жидкости или газе, происходящее под влиянием теплового движения молекул. Р. Броун (1827) наблюдал. Создание теории - А. Эйнштейн и М. Смолуховский (1905). Ж.Б. Перрен (1908—1911) — опыты. Движение не прекращается |
||
|
Роль в природе, технике
|
||
|
Скорость теплового движения молекул МКТ газов основана на том, что газы состоят из беспорядочно движущихся молекул. Понятие температуры связано со скоростью хаотического движения молекул формулой где - Так как NА.k=const=R, то
При t0=0°С средние скорости для азота – 500 м/с, для водорода – 1800 м/с. |
||
|
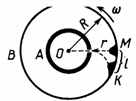
Экспериментальное определение скорости движения молекул Сущность опыта О. Штерна (1920)
|
|
|
|
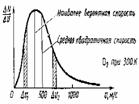
Распределение молекул по скоростям График распределения молекул по скоростям. Английский физик Дж. Максвелл и австрийский физик Л. Больцман. Кривая распределения Максвелла соответствует результатам, полученным в опыте Штерна. Количество частиц, имеющих скорости в интервале ΔV1, равно ΔN, V - одна из скоростей этого интервала. Из графика видно, что количество частиц, имеющих скорости в равных интервалах ΔV1 и Δv2, различно. Скорость, около которой расположены наиболее «населенные» интервалы,— наиболее вероятная скорость теплового движения молекул. |
|
|
|
Основные выводы
|
|
|